Trộn V 1 lít dung dịch H 2 S O 4 0,02M với V 2 lít dung dịch NaOH 0,035M ta thu được V 1 + V 2 lít dung dịch có pH = 2. Xác định tỉ lệ V 1 / V 2
A. 2
B. 3/2
C. 2/3
D. 1
Trộn 300ml dung dịch hỗn hợp H2SO4 0,04M và HNO3 0,02M với 300 ml dung dịch hỗn hợp NaOH 0,04M và Ba(OH)2 0,02M . Tính pH của dung dịch thu được .
HELP ME !!!!
Dung dịch A gồm H2SO4 0,03M và HCl 0,04M . Dung dịch B gồm NaOH 0,06M và Ba(OH)2 0,02M . Tính pH của dung dịch thu được khi trộn 100ml dung dịch A với 100 ml dung dịch B .
HELP ME !!!!!!!
Trộn 250ml dd H2SO4 0,15M với 250ml dd Na2CO3 0,08M thu được dung dịch A.
a) Tính nồng độ mol các ion trong dung dịch A
b) Trộn 1/2 thể tích dung dịch A với 250ml dung dịch B gồm Ba(OH)2 0,02M và NaOH x(M) thu được dung dịch V(ml) có pH=12 và m (g) kết tủa. Tính x và m?
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M thu được V1+ V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2 :
A. 3/2
B. 2/3
C. 2
D. 1
Đáp án A
nH+ = 0,04V1 (mol); nOH-= 0,035V2 (mol)
H++ OH- → H2O
Dung dịch sau phản ứng có pH = 2 nên axit dư
nH+ dư = 0,04V1- 0,035V2
[H+]dư = nH+ dư/ Vdd = (0,04V1- 0,035V2)/(V1+ V2) = 10-2
Suy ra V1/V2 = 3/2
1. Dung dịch X chứa \(FeSO_4,H_2SO_4\text{ loãng}\). Cho V(l) dung dịch \(X\) phản ứng vừa đủ với 60ml dung dịch \(KMnO_4\) \(0,02M\). Hỏi cần bao nhiêu lít dung dịch \(K_2Cr_2O_7\) \(0,02M\) để phản ứng hết với V(l) dung dịch X trên.
2. Hỗn hợp khí A gồm \(Cl_2,O_2\). A phản ứng vừa đủ với hỗn hợp gồm \(4,8\left(g\right)Mg\) và \(8,1\left(g\right)Al\) tạo ra 37,05 (g) hỗn hợp các muối clorua và oxit của hai kim loại. Tính %V các khí trong hỗn hợp A.
câu 1:
\(Fe^{+2}So_4+H_2SO_4+KMn^{+7}O_4\rightarrow Fe^{+3}_2\left(SO_4\right)_3+Mn^{+2}SO_4+K_2SO_4+H_2O\left(1\right)\)
\(Fe^{+2}So_4+H_2SO_4+K_2Cr^{+6}_2O_7\rightarrow Fe^{+3}_2\left(SO_4\right)_3+Cr^{+3}_2\left(SO_4\right)_3+K_2SO_4+H_2O\left(2\right)\)
Áp dụng bảo toàn e cho 2 phương trình trên:
phương trình (1) <=> \(n_{Fe}\times1=n_{Mn}\times5\) (mỗi Fe nhường 1e, mỗi Mn nhận 5e, số e nhường bằng số e nhận)
phương trình (2) <=> \(n_{Fe}\times1=n_{Cr_2}\times6\)(mỗi Fe nhường 1e, mỗi Cr nhận 3e =>mỗi Cr2 nhận 6e)
=>\(n_{Mn}\times5=n_{Cr_2}\times6\Leftrightarrow n_{k_2Cr_2O_7}=n_{Cr_2}=\dfrac{5}{6}n_{Mn}=\dfrac{5}{6}n_{KMnO_4}=\dfrac{5}{6}\times0,06\times0,02=0,001\)
=> \(v=\dfrac{0,001}{0,02}=0,05\left(l\right)\)
câu 2:
sơ đồ phản ứng: \(Mg^0,Al^0+Cl^0_2,O^0_2\rightarrow Mg^{+2}Cl_2^{-1},Mg^{+2}O^{-2},Al^{+3}Cl_3^{-1},Al_2^{+3}O_3^{-2}\)
\(n_{Mg}=\dfrac{4,8}{24}=0,2;n_{Al}=\dfrac{8,1}{27}=0,3\)
Bảo toàn electron:\(n_{Mg}\cdot2+n_{Al}\cdot3=n_{Cl}\cdot1+n_O\cdot2=1,3\)
\(n_{Cl}\cdot35,5+n_O\cdot16=37,05-4,8-8,1=24,15\)(bảo toàn khối lượng)
giải hệ trên =>\(n_{Cl}=0,5;n_O=0,4\)
=>\(n_{Cl_2}=\dfrac{1}{2}n_{Cl}=0,5\cdot\dfrac{1}{2}=0,25;n_{O_2}=\dfrac{1}{2}n_O=\dfrac{1}{2}\cdot0,4=0,2\)
\(\Rightarrow v\%Cl_2=\dfrac{0,25}{0,25+0,2}\cdot100\%=55,56\%\)
\(v\%Cl_2=\dfrac{0,2}{0,25+0,2}\cdot100\%=44,44\%\)
Trộn 300gam dung dịch Ba(OH)2 1,254% với 500ml dung dịch chứa H3PO4 0,04 M và H2SO4 0,02M . Tính khối lượng muối tạo thành.
Help me!!!
So sánh số mol H ( của axit ) và số mol OH ( của bazơ ) để biết axit hay bazơ còn dư .
\(m_{Ba\left(OH\right)_2}=\dfrac{300.12,54}{100}=3,762\left(gam\right)\) \(\Rightarrow\) \(n_{OH-}=2_{Ba\left(OH\right)_2}=2.\dfrac{3,762}{171}=0,044mol\)
\(n_{H+}=\left(3.0,5.0,04\right)+\left(2.0,5.0,02\right)=0,08mol\)
\(\Rightarrow\) Kiềm thiếu.
Phản ứng xảy ra theo trình tự :
H2SO4 + Ba(OH)2 \(\rightarrow\) BaSO4 \(\downarrow\) + 2H2O
Bđ : 0,01______0,022____________________________( mol )
Pư : 0,01\(\rightarrow\)___0,01____________0,01
Sau: 0______0,012___________0,01
Ta có : \(T=\dfrac{n_{H_2PO_4}}{n_{Ba\left(OH\right)_2}}=\dfrac{0,02}{0,012}\Rightarrow\) 1 < T < 2 \(\Rightarrow\) tạo ra 2 muối BaHPO4 và Ba(H2 PO4)2
Ba(OH)2 + H3PO4 \(\rightarrow\) BaHPO4 + 2H2O
x____________x___________x
Ba(OH)2 + 2H3PO4 \(\rightarrow\) Ba(H2PO4 )2 + 2H2O
y____________2y_____________y
suy ra ta có : \(\left\{{}\begin{matrix}x+y=0,012\\x+2y=0,02\end{matrix}\right.\) giải ra : x = 0,004 ; y = 0,008
Vậy khối lượng mỗi muối thu được là :
\(m_{BaSO_4}=\) 0,01 ´ 233 = 2,33 gam ; \(m_{BaHPO_4}=\) 0,004 ´ 233 = 0,932 gam ; \(m_{Ba\left(H_2PO_4\right)_2}=\) 0,008 ´ 331 = 2,648 g
* Chữa lại 1 phần nhỏ trong bài làm.
Ta có: \(T=\dfrac{n_{H_3PO_4}}{n_{Ba\left(OH\right)_2}}=\dfrac{0,02}{0,012}\) 1< T< 2 \(\Rightarrow\) tạo ra 2 muối BaHPO4 và Ba(H2 PO4)2
P/s: Cẩm Vân Nguyễn Thị, em xét mấy lần mới thấy chỗ này sai: là\(n_{H_3PO_4}\) chứ không phải \(n_{H_2PO_4}\). Nếu còn gì sai thì cô comment ở dưới tiếp nhé!
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M ta thu được V1 + V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2
A. 2
B. 3/2
C. 2/3
D. 1
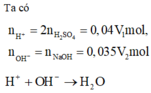
Để thu được dung dịch có pH = 2 chứng tỏ dung dịch sau phản ứng chứa axit dư [H+] dư = 0,01 M
→ nH+(du) = 0,04V1-0,035V2 = 0,01.(V1 + V2) → 0,03V1 = 0,045V2 → V1 : V2 = 3:2
Đáp án B
Trộn V1 lít dung dịch H2SO4 0,02M với V2 lít dung dịch NaOH 0,035M ta thu được V1 + V2 lít dung dịch có pH = 2. Xác định tỉ lệ V1/V2
A. 2
B. 3/2
C. 2/3
D. 1
Trộn X là dung dịch H2SO4 0,02M với Y là dung dịch NaOH 0,035M thu được dung dịch Z có pH = 2. Tính tỉ lệ về thể tích giữa dung dịch X và dung dịch Y( xem H2SO4 điện li hoàn toàn cả 2 nấc).